Auf dem Präsentierteller: Wie Virenbefall vom Immunsystem erkannt wird
BLOG: Detritus

Kürzlich habe ich mich entschieden, den Pflanzen und der Photosynthese den Rücken zu kehren und bin nun in der Strukturbiologie bzw. Immunologie gelandet. Ich werde mit einem Thema promovieren, dass die Struktur eines immunologisch wichtigen Proteinkomplexes betrifft, und gebe hier ein paar einführende Informationen zum Thema.
Unser Immunsystem ist ein äußerst komplexes Netzwerk aus verschiedenen Organen, Zelltypen und Molekülen. Es dient dazu, Krankheitserreger und schädliche Substanzen unschädlich zu machen und kann aber auch gezielt körpereigene Zellen töten.
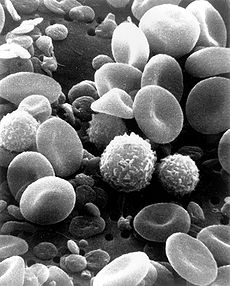 |
| Blutzellen unter dem Scanning-Elektronenmikroskop. Es sind die roten Blutzellen mit ihrer charakteristischen eingedellten Form erkennbar, und außerdem weiße Blutzellen, die Teil der Immunabwehr sind. (Bild: public domain) |
Aber warum sollte das Immunsystem denn auf körpereigene Zellen losgehen?Unter Umständen kann das sinnvoll sein: Cytotoxische („zellgiftige“) T-Zellen erkennen, ob eine Körperzelle in ihrem Inneren nur körpereigenes Material hat, oder wie im Fall einer viralen Infektion, fremde Proteine. Ist die Körperzelle von dem Erreger zu einer Virusfabrik umfunktioniert worden, ist es die beste Entscheidung, sich von dieser Zelle zu trennen, denn so kann man die Infektion eindämmen.
Um überhaupt „fremd“ und „nicht-fremd“ nach außen hin unterscheidbar zu machen, präsentieren fast alle Körperzellen kurze Abschnitte von zellulären Proteinen an ihrer Oberfläche, gebunden an einen darauf spezialisierten Proteinkomplex mit dem Namen „MHC“.
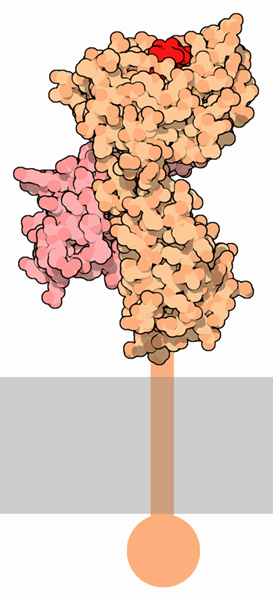 |
| Ein Peptid von nur wenigen Aminosäuren Länge (rot) wird von einem MHC-Komplex der Klasse I an der Zelloberfläche präsentiert (Zellmembran in grau). Die Verankerung in der Membran ist nur schematisch dargestellt. (Bild lizenziert unter der CC-BY-4.0-Lizenz von David S. Goodsell und der RCSB PDB) |
Das heißt, sowohl Proteine des eigenen Organismus, als auch solche von Eindringlingen werden im Zellinneren durch eine ständig aktive Protein-Zerhack-Maschine zu kurzen Peptiden gespalten, diese in zahlreich vorhandene „leere“ MHC-Komplexe integriert und dann an die Zellaußenseite geschleust. Ob ein bestimmtes Peptid an den MHC gebunden wird, wird von seinen physikochemischen Eigenschaften bestimmt, und nicht von seiner Sequenz. Ein und derselbe MHC kann hunderte unterschiedlicher Peptide binden, die typischerweise an bestimmten Stellen zumindest ähnliche Aminosäuren besitzen. Die T-Zelle besitzt eine Rezeptor, der genau diese Protein-Peptid-Komplexe erkennt und entweder als fremd oder nicht-fremd einordnet. Dieser Rezeptor heißt einfach T-Zell-Rezeptor (TCR) und ist an die Zelloberfläche der T-Zelle gebunden.
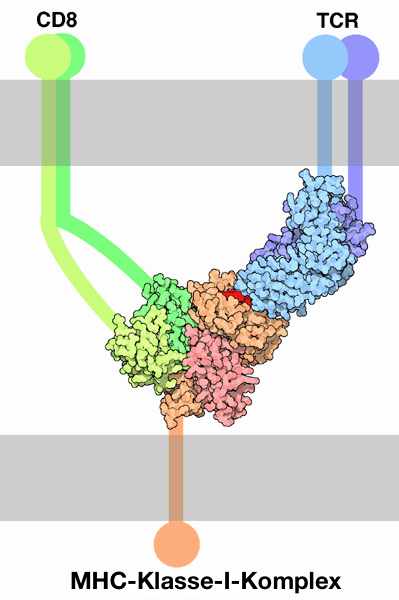 |
| Der T-Zell-Rezeptor (TCR, blau) bindet zusammen mit dem Corezeptor CD8 (grün) an den Peptid-Protein-Komplex. CD8 erkennt dabei, dass es sich um ein MHC der Klasse I handelt, wogegen der TCR gleichzeitig MHC und Peptid erkennt. (Bild von David Goodsell, verändert, Lizenz wie oben: CC-BY-4.0) |
Erkennt der T-Zellrezeptor ein fremdes Peptid, wird ein tödliches Programm eingeleitet, infolgedessen die gebundene Zelle Selbstmord begeht (Apoptose). Die Unterscheidung zwischen „fremd“ und „nicht-fremd” geschieht aber nur darüber, dass körpereigene Peptide gar nicht erst fest gebunden werden. Die Ursache für diese eigenartige Eigenschaft findet man im Verlauf der Lymphozytenentwicklung: Je nachdem, ob sich eine hämatopoetische Stammzelle des Knochenmarks entschließt, sich zu einem roten Blutkörperchen, zu einer antikörperproduzierenden B-Zelle, zu einer T-Zelle oder einer anderen weißen Blutzelle zu entwickeln, wird ein unterschiedliches Entwicklungsprogramm abgefahren. Zellen, die zu T-Lymphozyten werden wollen, wandern aus dem Knochenmark in den Thymus, einem beim Menschen oberhalb des Herzens liegenden Organ, wo sie ausdifferenzieren und selektiert werden.
Der Clou am adaptiven Immunsystem ist nämlich, dass die Informationen für die T- und B-Zell-Rezeptoren nicht etwa direkt auf dem Genom kodiert sind, sondern vielmehr durch ein zufälliges Kombinieren von Genabschnitten eine Vielfalt von Rezeptoren entsteht, die an alle möglichen und nicht möglichen Strukturen binden kann. Da ein Teil dieser zufällig erzeugten Rezeptoren entweder nicht funktionieren, oder auch körpereigene Strukturen erkennen können, muss sortiert werden. Nicht funktionale Rezeptoren sind nutzlos, und selbst-reaktive Rezeptoren würden zu einem Angreifen körpereigenen Gewebes führen, zu Autoimmunreaktionen also. Im Thymus treffen die T-Vorläuferzellen auf spezialisierte Zellen, die nichts anderes tun, als körpereigene Peptide im Komplex mit MHC-Molekülen auf ihren Oberflächen zu präsentieren. Sollte nun eine T-Vorläuferzelle stark an das körpereigene Peptid binden, wird sie abgetötet (negative Selektion). Bindet sie aber überhaupt nicht, wird sie paradoxerweise ebenfalls abgetötet (positive Selektion). Eine Zelle, die nicht bindet, erkennt nämlich mit hoher Wahrscheinlichkeit gar keine Peptid-Protein-Komplexe und wäre nutzlos. So überleben nur schwach selbst-bindende Zellen, ganze 95% der Ausgangszellen fallen dem Selektionsprozess zum Opfer.
Warum ist das nun interessant? Wie es scheint, ist der Selektionsprozess in einigen Fällen wirklich nicht streng genug und es kommt zu Autoimmunkrankheiten. Die MHC-Komplexe scheinen daran nicht ganz unschuldig zu sein, denn sie sind sowohl an der T-Zell-Selektion mit Hilfe körpereigener Peptide, als auch an der Präsentation körperfremder Peptide beteiligt. Die Gene für die MHC-Komplexe werden aber vererbt und nicht, wie die T-Zell-Rezeptoren, durch ein Mixen der Genabschnitte neu kombiniert. So gibt es eine Reihe von MHC-Genen, die immer wieder bei Menschen auftauchen, die unter bestimmten Autoimmunkrankheiten leiden.
Besonders bemerkenswert ist das HLA-B27-Gen, dessen Variante HLA-B27*09 völlig unauffällig ist, in der minimal abweichenden Variante HLA-B27*05 an der Entstehung von Morbus Bechterew beteilgt zu sein scheint. Genau gesagt, unterscheiden sich die beiden Proteine nur durch eine einzige Aminosäure.
Inwiefern dieser kleine Unterschied einen so großen Effekt auf die Präsentation des Peptids und damit auf die fehlerhafte Erkennung durch T-Zell-Rezeptoren hat, ist alles andere als klar.
Ein paar Hypothesen und postulierte Mechanismen präsentiere ich in einem späteren Beitrag: „Das Rätsel von Morbus Bechterew“.


Kuhl
Klingt interessant das Thema und über Immunologie kann man in Zeiten von “Big Alternative” sowieso nie genug wissen.
Autoimmunerkrankungen auf der einen Seite, Krebstherapie mit monoklonalen Antikörpern auf der anderen Seite wird der Zweig auf jedenfall auch in naher Zukunft ziemlich spannend bleiben.
Peptid Präsentation
Glückwunsch zur Wahl des Promotionsthemas! Immunologie is auf jeden Fall ne coole Sache, wenn auch ungeheuer komplex. Allein die ganzen T-Zell-Populationen… aber was mir beim Lesen aufgefallen ist: Du schreibst, dass MHC-Moleküle auch körpereigene Moleküle präsentieren und zwar ständig – was ich bisher nicht wusste. Aber stammen denn die körpereigenen Peptide nicht aus einem anderen Organell als die viralen. Die körpereigenen werden meines Wissens im Proteasom zerkleinert und die viralen im Lysosom. Die Peptide müssen ja dann in den Golgi kommen, um auf MHC-Moleküle geladen zu werden…gibt’s da dann zwei separate Transportwege!? Warum werden überhaupt körpereigene Peptide präsentiert und nicht komplett recycled!?
Muss zugeben, dass es schon ein paar Jahre zurückliegt, dass ich mich mit dem Thema beschäftigt hab…kann sein, dass ich was vergessen habe und was durcheinander bring 🙂
@Stefan
Hallo Stefan,
die Präsentation von „self-Antigenen“ muss ja stattfinden, sonst wäre ja keine Selektion mit diesen im Thymus (T-Zellen) bzw. in Knochenmark/Bursa fabricii (B-Zellen) möglich. Ich bin mir aber nicht sicher, ob das für MHC-I und -II gleichermaßen gilt, das muss ich nachschlagen. Denn es gibt auf jeden Fall zwei separate Transportwege für MHC-I und -II, die letzteren werden nach der Synthese sogar mit einem Platzhalterpeptid ausgestattet (CLIP), wogegen dann das passende endgültige Peptid eingetauscht wird. MHC-I wird auf jeden Fall im ER beladen und die Proteine werden erst über den TAP-Transportweg importiert, und dort sind auch self-Peptide dabei, die vom Proteasom zerknabbert wurden, dabei.
Kurz gesagt, sind MHC-I für cytosolische Peptide zuständig (viraler Befall, oder bakterielle Erreger, die aus dem Endosom ausgebrochen sind -> cytosolic/endogenous pathway), und MHC-II ist für extrazellulär aufgenommene Erreger verantwortlich, die im Lysozym verdaut werden (endozytotischer/exogener pathway).
Viele Grüße
Martin
@Martin
Hallo Martin!
Dass das für die Selektion von Zellen nötig ist, macht auf jeden Fall Sinn; hab ich nicht bedacht. Ich dachte aber eher nicht an Zellen, die spezifisch Selbst-Antigene präsentieren, sondern an “irgendwelche” anderen Zellen, die MHC-I präsentieren können, beispielsweise Zellen von Gefäßwänden. Sind die ständig – also auch ohne Infektion – damit beschäftigt, zufällige Selbst-Antigene zu präsentieren?
Gruß Stefan
@Stefan
Ja 🙂
Noch ein paar Gedanken dazu: MHC-Moleküle müssen im Überschuss exprimiert werden, damit schnell auf eine Infektion reagiert werden kann, und meines Wissens werden sie das auch. Da der MHC nicht zwischen selbst- und nicht-selbst-Antigenen unterscheidet, dafür ist ja der TCR verantwortlich, werden körpereigene Peptide genauso eingebaut, wie etwa solche aus Virusproteinen. Es geht ja in erster Linie um Ankerresiduen, die an Schlüsselpositionen bestimmte Eigenschaften haben müssen (sauer/basisch/hydrophob/…). Das Proteasom ist ständig aktiv und baut halt Ubiquitin-markierte Proteine ab. Wenn die Zelle infiziert ist, überwältigt sie der Virus-Protein-Output sowieso fast, insofern wird in dieser Situation weit überwiegend Virus-Antigen an der Oberfläche präsentiert werden, vemute ich.
MHC-I finden sich, bis auf ein paar Ausnahmen wie Erythrozyten, auf allen Körperzellen. MHC-II nicht, die findet man vor allem auf professionellen Antigen-präsentierenden Zellen (Dendritische Zellen, Makrophagen, …).
Viele Grüße
Martin
Danke 🙂
Hi Martin!
Okay, hab’s geschnallt 😉 Irgendwie hatte ich fest einzementiert, dass nur im Infektionsfall passiert; keine Ahnung, warum… Aber so macht’s auf jeden Fall Sinn!
Gruß und Dank,
Stefan
Ich hab nochmal nachgelesen, und das steht so auch in der Wikipedia: Für die positive Selektion der T-Zellen ist das Cortexepithel des Thymus zuständig, die self-Peptide an MHC-I und -II präsentieren. Die negative Selektion im Thymus dagegen wird durch professionelle Antigen-präsentierende Zelle (dendritische Zellen und Makrophagen, u.a.) durchgeführt. Das passiert ebenfalls mit self-Peptiden.
Es scheint wirklich so zu sein, dass reife, aktivierte dendritischen Zellen, die auch naive T-Zellen stimulieren können, „ein wenig“ self-Antigene präsentieren. Da die dendritischen Zellen durch einen Infektion aktiviert wurden, sollte das non-self-Antigen im Überschuss vorliegen. Außerdem habe sie kostimulierende Rezeptoren, die T-Zellen aktivieren. Der Janeway meint, dass das kein Problem sein, weil die T-Zellen ja gegen allgegenwärtige self-Antigene selektiert worden seien.
Dazu gibt es noch dendritische Zellen, die gegen Ende ihrer Lebensspanne noch nicht aktiviert wurden und dann auch keine T-Zell-aktivierenden costimulierenden Rezeptoren besitzen. Die wandern dann auch aus den Geweben in das Lymphsystem und präsentieren dort self-Antigene. Da sie aber, da selbst nicht aktiviert, keine costimulierenden Rezeptoren besitzen, fördern sie die Toleranz gegen self-Antigene: naive T-Zellen, die zwar Antigen erkennen, aber keine Costimulation (B7/CD28) erfahren, fallen in eine Art Tiefschlaf („Anergie“) und können überhaupt nocht mehr aktiviert werden.
Ohne die Nachfragen hätte ich das nicht nochmal nachgeschaut, jetzt reicht es sogar für einen Extra-Blogeintrag zum Thema T-Zell-Selektion und unterschiedliche Antigen-Präsentation. Danke dafür!
@Martin
Danke fürs Nachlesen 🙂 Ich hab ne alte Ausgabe vom Janeway auch irgendwo rumliegen…komm aber nicht recht dazu, mal wieder zu schmöckern. Ein Protein bzw. dessen Reinigung wollte heute nicht so wie ich. Weiß ja nicht, ob ich das schwerpunktmäßig machen möchte … Dir bleibt als Kristallographen (oder NMRler?) in spe ja nichts anderes übrig 😉
Gruß Stefan